
L’imagerie ophtalmologique pour des affections rétiniennes courantes :
Progrès en matière de visualisation de l’œil
Par Keyvan Koushan, M.D., FRCSC
Contrairement à la plupart des organes, l’œil peut être étudié et visualisé à différents niveaux. Les modalités d’imagerie de la rétine et de la choroïde se développent sans cesse, ce qui nous permet d’accroître nos connaissances sur la structure et la fonction de ces tissus. Grâce à ces progrès technologiques, nous avons une meilleure compréhension de diverses maladies rétiniennes. Ce numéro d’Ophtalmologie – Conférences scientifiques donne un aperçu des outils d’imagerie les plus couramment utilisés pour la rétine et examine brièvement leur application pour un certain nombre de maladies rétiniennes courantes.
Diverses modalités d’imagerie rétinienne
Photographie du fond d’œil
Introduite initialement par Jackman et Webster en 1886[1], la photographie du fond d’œil est devenue un élément essentiel de l’évaluation et de la documentation rétinienne. Les caméras de fond d’œil combinent un éclairage par flash lumineux aux principes de l’ophtalmoscopie indirecte pour enregistrer des images de la rétine. La lumière est produite par une lampe de visualisation ou un flash électronique. Elle passe ensuite à travers une série de filtres et de miroirs pour prendre une forme annulaire (i.e., la partie centrale n’est pas éclairée). Cette lumière, de forme annulaire, est ensuite réfléchie par la rétine. L’alignement correct de la caméra permettra à la lumière réfléchie de passer à travers le centre de l’anneau lumineux et celle-ci sera enregistrée par une caméra ou un appareil photographique numérique[2]. L’angle de visualisation de la plupart des appareils photographiques du fond d’œil varie de 30º à 50º. Les images obtenues avec un champ visuel de 45 à 60º sont généralement appelées des images grand angle. La photographie standard de 7 champs du fond d’œil est principalement utilisée dans les essais cliniques et utilise 7 images de 30º chacune pour capturer une vue plus large du fond d’œil (Figure 1). Les images ultra grand angle sont obtenues en utilisant les nouvelles caméras laser qui capturent des images d’une largeur de champ allant jusqu’à 200º. Ces caméras utilisent différentes longueurs d’onde de lumière laser pour obtenir de multiples images et recréer ensuite les couleurs sur l’image finale. Il a été démontré que cette technique avait une très bonne concordance diagnostique avec les photographies stéréoscopiques standard de 7 champs et l’examen clinique dans le contexte de la rétinopathie diabétique (RD) ou en présence de masses choroïdiennes pigmentées[3,4].
Imagerie rétinienne monochromatique
Vogt a décrit l’utilisation de la lumière verte « exempte de rouge » pour améliorer la visualisation du fond d’œil[5]. Cette technique utilise différentes propriétés de réflectivité des couches du fond d’œil pour améliorer la visualisation de certaines de ses structures en ayant recours à l’illumination monochromatique au moyen de filtres. Les filtres bleu, vert ou rouge sont couramment utilisés pour cette modalité d’imagerie et chacun fourni un contraste accru pour des structures du fond d’œil spécifiques. Par exemple, la lumière verte (exempte de rouge) est partiellement réfléchie par l’épithélium pigmentaire rétinien (EPR) et est absorbée par le sang. Sa dispersion est minimale et elle fournit un bon contraste et une bonne vue globale du fond d’œil.
Angiographie à la fluorescéine (AF)
L’AF est fondée sur les mêmes principes optiques que la photographie du fond d’œil, mais elle utilise également la propriété de fluorescence de la fluorescéine sodique : absorption de la lumière à de plus courtes longueurs d’onde et réémission à de plus grandes longueurs d’onde. La fluorescéine sodique est excitée par la lumière bleue (longueur d’onde d’excitation de 465-490 nm) et réémet la lumière jaune-verte (longueur d’onde d’excitation de 520-530 nm). La caméra est dotée d’un filtre bleu qui ne laisse passer que la lumière bleue dans l’œil. Une partie de cette lumière bleue est réfléchie par la rétine et revient vers la caméra et une partie excite la fluorescéine sodique à l’intérieur des vaisseaux sanguins ou ailleurs dans la rétine. La lumière fluorescente jaune-verte réémise avec la lumière bleue réfléchie revient ensuite vers la caméra et passe à travers un filtre jaune-vert avant d’être enregistrée dans une échelle de gris. Par conséquent, toute lumière jaune-verte réémise est enregistrée comme brillante par la caméra et d’autres couleurs seront enregistrées comme sombres[6]. Le Spectralis HRA de Heidelberg Engineering et le 200 Tx d’Optos®, fondés sur la technologie d’ophtalmoscopie confocale à balayage laser (cSLO), utilisent la lumière de laser monochromatique (au lieu de la lumière du flash) pour exciter les molécules de fluorescéine sodique et la capture d’images confocales pour une meilleure focalisation. Cela augmente significativement la résolution des images et réduit les artéfacts associés à l’AF avec utilisation d’un flash, tels que la dispersion des courtes longueurs d’onde et l’autofluorescence du cristallin[5,7]. L’AF à ultra-grand angle offre l’avantage de capter la pathologie au-delà de l’équateur. Les caméras Optos peuvent capturer des images à plus de 200º (centrées sur la région médiane du corps vitré ; Figure 2A). Les systèmes Heidelberg dotés de lentilles avec ou sans contact peuvent également capturer des images d’un champ aussi large que 150º (Figure 2B).
Dans toutes les modalités, l’hyperfluorescence indique l’un des scénarios suivants : 1) fuite du colorant (p. ex., fuite par des microanévrismes dans la RD) ; 2) accumulation du colorant (p. ex., dans les décollements de l’épithélium pigmentaire [DEP]) ; 3) effet fenêtre par altération de l’EPR produisant une fluorescence plus prononcée de la choroïde et de la sclère (p.ex., atrophie géographique dans la dégénérescence maculaire liée à l’âge [DMLA]) ou 4) coloration des structures avec le colorant (p. ex., coloration des drusen dans la DMLA). Par opposition, l’hypofluorescence indique une hypoperfusion des tissus (p. ex., une ischémie maculaire dans la RD) ou un blocage de la lumière fluorescente (p. ex. présence d’une hémorragie épirétinienne dans la RD).
Angiographie au vert d’indocyanine (VIC)
Le VIC absorbe et émet la lumière dans le proche infrarouge. Son absorption maximale est à 790 nm et son émission maximale est à 835 nm. L’angiographie au VIC est une modalité d’imagerie idéale pour visualiser une pathologie choroïdienne étant donné que le colorant permet la visualisation à travers l’EPR, le pigment xanthophylle rétinien et les espaces liquidiens de la rétine (Figure 3). De plus, son poids moléculaire élevé (774,96 Da) et sa liaison au plasma dans une proportion élevée (98 %) entraînent une fuite minimale du colorant à partir des vaisseaux choroïdiens fenêtrés sains. Par conséquent, les zones choroïdiennes hyperfluorescentes à l’angiographie au VIC (plaques ou « hot spots ») indiquent généralement une pathologie[6].
Autofluorescence du fond d’œil (FAF)
L’imagerie d’autofluorescence du fond d’œil est une méthode de visualisation des grains de lipofuscine (et autres fluorophores mineurs) présents naturellement ou pouvant s’accumuler de façon pathologique dans le fond d’œil. L’accumulation de lipofuscine dans les cellules de l’EPR est un signe de vieillissement. Une accumulation excessive de lipofuscine signe de nombreuses affections qui touchent l’EPR, telles que la DMLA ou diverses formes de dystrophie réticulée. Les grains de lipofuscine ont des propriétés autofluorescentes, ce qui signifie que lorsqu’ils sont stimulés par la lumière bleue, ils émettent une lumière fluorescente dans le spectre vert-jaune[6]. De même, l’autofluorescence dans le proche infrarouge utilise d’autres fluorophores du fond d’œil (tels que la mélanine) qui possèdent des propriétés d’autofluorescence dans le spectre proche infrarouge[8,9]. Ainsi, l’autofluorescence du fond d’œil et l’autofluorescence dans le proche infrarouge permettent la visualisation non invasive des modifications pathologiques survenant dans l’EPR (Figures 4A-4C)[10].
Les caméras du fond d’œil peuvent être équipées de capacité d’imagerie d’autofluorescence du fond d’œil avec des filtres relativement peu coûteux pour limiter la lumière d’excitation dans le spectre du bleu et la lumière émise dans le spectre orange-vert. Le défi technique que représente l’imagerie d’autofluorescence du fond d’œil utilisant ces caméras est le très faible niveau de lumière fluorescente naturelle du fond d’œil comparativement à l’intensité de la lumière fluorescente émise durant l’AF ainsi que l’interférence provenant de l’autofluorescence naturelle des cristallins atteints de cataracte. La technologie cSLO (p. ex. le système Spectralis de Heidelberg ou 200 Tx d’Optos) résout ces problèmes en utilisant une seule longueur d’onde laser à faible énergie pour exciter les fluorophores et les filtres appropriés pour la lumière émise. L’utilisation de systèmes optiques confocaux dans la technologie cSLO élimine également le problème de la dispersion de la lumière et de la réflectance secondaire[11].
Imagerie échographique
L’échographie utilise des ondes acoustiques à des fréquences > 20 kHz. Des fréquences plus élevées signifient des longueurs d’onde plus courtes, ce qui se traduit par une pénétration moindre dans les tissus, mais une plus haute résolution des images finales. La technologie de l’échographie en mode B utilisée couramment en imagerie rétinienne utilise généralement des fréquences de 8 à 10 MHz et pénètre à une profondeur d’environ 40 mm. Cependant, la résolution des images produites n’est que d’environ 0,5 à 0,9 mm. Par opposition, la biomicroscopie ultrasonore, qui permet de visualiser en détail le segment antérieur, utilise des fréquences de 20 à 50 MHz, une profondeur de pénétration de seulement 5 à 10 mm et une résolution de 0,04 mm. La rapidité des ondes, leur réflectivité, l’angle d’incidence et l’absorption par le milieu sont autant d’éléments qui influent sur l’image finale. La rapidité dépend de la densité du milieu de conduction.
Une échographie en mode A utilise une représentation unidimensionnelle de la réflectivité des ultrasons pour déduire des informations sur la longueur axiale et les structures oculaires. L’angle d’incidence doit être surveillé précisément au moment où l’on obtient des informations d’une image échographique en mode A étant donné qu’une sonde mal positionnée peut entraîner des mesures inexactes de la longueur axiale. L’échographie en mode B utilise une sonde qui balaie un plan pour produire de multiples balayages en mode A sur ce plan. Il en résulte une image échographique bidimensionnelle de l’œil qui peut être utilisée pour déduire des informations sur des affections, telles que les tumeurs oculaires, les décollements de la rétine, les déchirures de la rétine, les hémorragies du vitré ou le décollement postérieur du vitré.
Tomographie par cohérence optique (TCO)
L’avènement de la TCO a eu un impact important sur l’imagerie rétinienne et la pratique de l’ophtalmologie. La TCO est fondée sur le principe d’une interférométrie à faible cohérence, ce qui signifie que l’interférence d’une lumière de référence et la lumière qui est réfléchie par les tissus sont utilisées pour élaborer des images des couches rétiniennes. Ces schémas d’interférence sont utilisés pour élaborer des balayages axiaux en mode A à chaque point incident. La combinaison de ces images est utilisée pour effectuer des balayages bidimensionnels en mode B, qui donnent les images familières à la plupart des utilisateurs[6].
La TCO offre une imagerie rétinienne à très haute résolution qui a permis la prise en charge et le suivi précis de nombreuses affections rétiniennes. La plupart des appareils commerciaux de TCO offre une résolution axiale de 5 µm et les instruments de recherche ont des résolutions axiales encore plus élevées. Cependant, la résolution latérale est limitée par la diffraction de la lumière induite par la pupille et est d’environ 20 µm[12}. La technologie TCO antérieure, appelée la TCO dans le domaine temporel, utilisait un seul détecteur de lumière et un miroir mobile pour élaborer chaque balayage en mode A. Cette technologie limitait la vitesse d’acquisition de l’instrument à quelques milliers de balayages en mode A par seconde. La TCO dans le domaine spectral (DS) ou de Fourier offre des vitesses d’acquisition significativement plus élevées grâce à l’utilisation d’un ensemble de détecteurs et de multiples longueurs d’onde de lumière dans l’ensemble d’un spectre (d’où le nom « domaine spectral »). Cette technologie permet de réaliser jusqu’à 100 000 balayages en mode A par seconde. La plupart des appareils de TCO-DS offre des vitesses de 27 000 à 40 000 balayages en mode A par seconde.
La TCO à source balayée (SB) utilise un faisceau laser qui balaye dans une gamme de longueurs d’onde. Ces longueurs d’onde sont généralement plus longues (de l’ordre d’environ 1 µm) que celles utilisées dans la TCO-DS (gamme d’environ 840 nm). Elles pénètrent plus profondément dans les tissus et permettent une meilleure visualisation choroïdienne et sclérale. Les récepteurs à photodiodes des appareils de TCO-SB ont la capacité de fonctionner à très haute vitesse, ce qui permet des temps d’acquisition courts. Cependant, la technologie de la TCO-SB comporte quelques inconvénients. Étant donné que la résolution des images est réduite en raison des longueurs d’onde accrues, les images de TCO-SB ont une résolution légèrement moins bonne comparativement aux images de TCO-DS. De plus, l’absorption accrue des longueurs d’onde plus longues par l’eau restreint la gamme des largeurs de bande qui peuvent être utilisées par la TCO-SB, ce qui limite encore davantage la résolution des images[6,13].
L’angiographie-TCO marque une évolution de la technologie de la TCO qui utilise le contraste de mouvement pour visualiser le flux sanguin rétinien et choroïdien sans l’injection d’un produit de contraste. L’angiographie-TCO repose sur le balayage répété d’une zone, puis l’examen des images séquentielles pour détecter tout changement[14]. L’image résultante a l’aspect d’un angiogramme, mais offre les avantages d’un temps d’acquisition court (environ 3 secondes) et d’une haute répétabilité. De plus, les images d’angiographie-TCO fournissent des informations tridimensionnelles sur la localisation des structures visualisées, ce qui permet aux cliniciens de faire facilement la différence entre un système microvasculaire normal et anormal dans la rétine superficielle, dans la rétine profonde et dans la choroïde (Figures 5A-5D). Cependant, contrairement à l’autofluorescence traditionnelle, l’angiographie-TCO n’a pas la capacité de montrer une fuite vasculaire. Par conséquent, le clinicien doit déduire la présence d’une fuite d’après les modifications rétiniennes kystiques sur les images de TCO juxtaposées (Figures 5E, 5F). De plus, la technologie actuelle de l’angiographie-TCO favorise la dégradation des images en raison des mouvements oculaires, des artéfacts de projection et d’autres facteurs[14].
Modalités d’imagerie dans certaines affections rétiniennes chroniques
Trous maculaires
La TCO est la principale modalité d’imagerie utilisée pour le diagnostic, la stratégie de prise en charge et le suivi des trous maculaires. En fait, le groupe d’étude international sur la traction vitréomaculaire (International Vitreomacular Traction Study Group) a élaboré un système de classification anatomique entièrement fondé sur la TCO pour différents stades de traction vitréomaculaire (TVM) et de trous maculaires[15]. Selon cette classification, l’adhérence vitréomaculaire est définie comme la séparation vitréomaculaire périfovéale avec adhérence vitréomaculaire persistante sans modification de l’anatomie fovéale. Cela peut entraîner une TVM qui est caractérisée par la déformation du contour fovéal et peut inclure des pseudokystes, un schisis maculaire, un œdème maculaire cystoïde ou la présence de liquide sous-rétinien. La TVM peut être sous-classifiée sur la base des mesures de TCO en attachement vitréomaculaire focal (≤ 1500 µm) ou large (> 1500 µm). Un trou maculaire de pleine épaisseur (TMPE) est une lésion fovéale caractérisée par l’interruption des couches rétiniennes de la membrane limitante interne à l’EPR[15]. Le TMPE peut à son tour être associé ou non à une TVM, ce qui a des implications sur les options de traitement disponibles (Figures 6A, 6B).
Choriorétinopathie séreuse centrale (CRSC) chronique
La CRSC est une affection mal comprise qui touche principalement les hommes jeunes ou d’âge moyen. Les stéroïdes exogènes, le stress et la personnalité de « type A » sont des facteurs de risque possibles[16,17]. On pense que la physiopathologie de ce type d’affection touche les choriocapillaires et l’EPR, ce qui entraîne une accumulation de liquide sous-rétinien avec une vision réduite et déformée[18]. De multiples modalités d’imagerie peuvent être utilisées pour obtenir des renseignements sur les caractéristiques de la CRSC pour chaque patient. Les modalités couramment utilisées sont la TCO, l’AF et la FAF. L’angiographie au vert d’indocyanine et l’angiographie-TCO peuvent également jouer un rôle dans la prise en charge de cette affection.
La TCO est la principale modalité d’imagerie pour diagnostiquer la CRSC et effectuer le suivi des patients qui en sont atteints (Figures 7A, 7B). La principale observation révélée par la TCO est la présence de liquide sous-rétinien qui touche généralement le centre de la fovéa. D’autres observations faites en TCO incluent des irrégularités de la rétine externe et de l’épithélium pigmentaire, telles qu’un décollement de l’épithélium pigmentaire. À l’occasion, la présence de liquide intrarétinien est également observée sur les images de TCO de cas atteints de CRSC chronique. Le clinicien doit exclure la présence d’une membrane néovasculaire choroïdienne (NVC) concurrente dans ces cas.
L’AF peut être utilisée pour détecter des zones de fuite au niveau de l’EPR entraînant la présence de liquide sous-rétinien. L’identification de ces zones confirme le diagnostic et est également importante pour l’établissement d’un traitement au laser éventuel (Figures 8A, 8B). De plus, comme nous l’avons mentionné précédemment, l’AF est utilisée pour exclure la présence d’une membrane NVC dans les cas douteux ou chroniques. L’identification de zones d’altérations de l’EPR, en dehors de la zone affectée ou dans l’œil controlatéral, confirme le diagnostic de CRSC.
Classiquement, l’angiographie au vert d’indocyanine montre de multiples zones d’hyperperméabilité choroïdienne aux phases intermédiaire et tardive de l’angiographie. Ces zones entourent généralement les fuites situées au niveau de l’EPR, mais peuvent également être observées en dehors de la zone de fuite et dans l’œil controlatéral18. L’identification de ces zones est importante pour l’établissement d’un traitement éventuel de la CRSC, tel qu’une thérapie photodynamique pleine-fluence ou demi-fluence[19].
L’angiographie-TCO n’est pas une modalité d’imagerie habituelle pour établir le diagnostic de CRSC, étant donné qu’elle ne montre pas les fuites. Cependant, de nouvelles données suggèrent que l’angiographie-TCO permet de visualiser un flux sanguin anormal au niveau des choriocapillaires dans la CRSC. Plus précisément, des zones de flux sanguin réduit dans les choriocapillaires entourées de zones hyperperfusées ont été observées dans les cas de CRSC chronique[20].
Rétinopathie diabétique (RD)
La physiopathologie de la RD est liée à des modifications de la paroi des capillaires dues à une hyperglycémie chronique. Ces modifications entraînent une incompétence vasculaire et une hypoxie chronique ainsi que des modifications structurelles subséquentes dans la rétine.
L’AF demeure une modalité importante pour documenter diverses modifications pathologiques observées dans la RD. L’AF permet de documenter une fuite vasculaire diffuse ou focale dans la RD et peut être utilisée pour guider le laser maculaire focal dans le traitement de l’œdème maculaire diabétique. L’AF est également une modalité importante pour le diagnostic de l’ischémie maculaire, qui est identifiée comme une zone avasculaire fovéale élargie. De plus, l’AF est utilisée de façon routinière pour identifier ou confirmer la présence d’une néovascularisation rétinienne au niveau du disque optique (NVD) ou ailleurs (NVA) (Figure 9). L’AF à grand angle est particulièrement utile pour identifier les zones périphériques de non-perfusion et la néovascularisation rétinienne, qui peuvent facilement passer inaperçues lors d’un examen clinique.
La TCO en tant qu’instrument diagnostique non invasif est utilisé pour le suivi habituel des patients atteints de RD. La TCO est particulièrement utile pour la documentation et le suivi de l’œdème maculaire diabétique, qui apparaît comme un épaississement maculaire en TCO. En revanche, un amincissement maculaire excessif (tel qu’un amincissement du complexe cellulaire ganglionnaire) en TCO peut suggérer une ischémie maculaire[21,22]. L’angiographie-TCO est un instrument prometteur pour documenter l’agrandissement et le remodelage de la zone avasculaire fovéale et le remodelage du plexus vasculaire chez les patients diabétiques[23-25].
Dégénérescence maculaire liée à l’âge (DMLA)
La DMLA est une cause fréquente de perte de vision parmi les patients âgés, en particulier les patients caucasiens. Les allèles spécifiques à risque génétique, la pigmentation claire de l’iris, le sexe féminin, les antécédents de tabagisme et les antécédents d’exposition au soleil sont d’autres facteurs de risque importants[26-28]. La DMLA est généralement divisée en types non exsudatif (sèche) et exsudatif (néovasculaire ou humide), ce dernier étant associé à la présence de membranes NVC. De multiples modalités d’imagerie sont utilisées pour documenter le stade de la DMLA et en particulier pour différencier la DMLA exsudative de la DMLA non exsudative.
L’AF est la modalité d’imagerie traditionnelle pour documenter et caractériser les lésions de NVC dans la DMLA exsudative. D’après le type de fuite visible à l’AF, les lésions de NVC peuvent être qualifiées de classiques ou d’occultes[29]. La NVC occulte est caractérisée par une hyperfluorescence précoce qui augmente de taille et d’intensité aux phases intermédiaire et tardive de l’angiographie. La NVC occulte comprend deux types de fuite : 1) DEP fibrovasculaire, qui apparaît comme des zones définies précocement d’hyperfluorescence tachetée qui peuvent ou non montrer une fuite à la phase tardive de l’angiographie (Figure 10) ; 2) fuite tardive d’origine indéterminée, qui apparaît généralement comme une hyperfluorescence mal définie aux phases intermédiaire ou tardive de l’angiographie (Figures 11A, 11C). À l’ère de la thérapie photodynamique, la classification des lésions de NVC en lésions classiques vs occultes a eu des implications significatives dans les décisions thérapeutiques. Avec l’avènement des anti-VEGF (inhibiteurs du facteur de croissance de l’endothélium vasculaire), la classification des lésions guidée par l’AF en lésions classiques et occultes ne modifie plus le paradigme de traitement, mais l’obtention d’une AF initiale permet de confirmer le diagnostic de DMLA exsudative et est utilisée pour exclure d’autres lésions déguisées (telles que la CRSC chronique).
Bien que l’angiographie au vert d’indocyanine ne soit plus utilisée de façon routinière dans les cas de DMLA, elle peut permettre de mieux localiser les lésions de NVC dans la DMLA exsudative. Plus précisément, l’angiographie au vert d’indocyanine est très utile pour visualiser les lésions de NVC sous l’EPR (appelées également de type 1 ou occultes ; Figure 3)[29] ou la prolifération angiomateuse rétinienne.
L’autofluorescence du fond d’œil peut être utile pour documenter et effectuer le suivi de l’atrophie géographique dans la DMLA sèche. Une atrophie géographie apparaîtra comme des zones sombres (hypoautofluorescence) sur les images d’autofluorescence du fond d’œil, qui peuvent être utilisées pour la documentation en série de ces lésions.
La TCO est devenue la principale modalité d’imagerie pour le diagnostic et le suivi de la DMLA sèche et humide. La TCO permet de documenter l’atrophie de la rétine et de l’épithélium pigmentaire dans la DMLA sèche et elle est particulièrement utile pour documenter les manifestations de la DMLA exsudative, incluant le DEP, la présence de liquide intrarétinien et sous-rétinien et l’épaisseur/le volume de la rétine[30]. Elle permet également d’identifier des hémorragies et des lésions de NVC (Figure 12)[31]. Lors du suivi des patients atteints de DMLA exsudative, la plupart des cliniciens considèrent la présence de liquide sous-rétinien et intrarétinien mis en évidence par la TCO comme la preuve objective d’une lésion active. L’angiographie-TCO fournit une nouvelle méthode de visualisation des membranes néovasculaires dans la DMLA humide[32]. Ces lésions ont été décrites comme une tête de méduse (i.e., ramifications dans toutes les directions à partir du centre de la lésion) ou en forme d’éventail de mer (i.e. ramification d’un côté de la lésion à partir d’un axe central)[33]. Les images en série d’angiographie-TCO peuvent être utilisées pour documenter la réponse au traitement anti-VEGF et il a été démontré que le traitement anti-VEGF entraîne une diminution de la taille et de la densité des vaisseaux (Figures 13A-13E)[34].
Rétinopathie drépanocytaire
La rétinopathie drépanocytaire constitue un spectre de modifications vasculaires ischémiques proliférantes et non proliférantes observées chez les patients atteints de drépanocytose. L’AF grand angle est utile pour identifier et/ou confirmer la néovascularisation (NV) périphérique chez les patients atteints de rétinopathie drépanocytaire (Figures 2A, 2B) et peut démontrer des zones de non-perfusion périphérique qui pourraient être des sites de NV future.
Naevi choroïdiens et mélanomes
Les naevi choroïdiens sont des manifestations fréquentes au niveau du segment postérieur observées chez 7,9 % des patients caucasiens[35]. L’identification d’un naevus soulève fréquemment la possibilité d’une transformation maligne en un mélanome choroïdien. Par conséquent, la documentation précise des naevi au moyen de photographies et d’une échographie du fond d’œil est importante pour détecter une transformation maligne précoce. Si disponibles, des images d’autofluorescence du fond d’œil sont également utiles pour documenter la présence de drusen recouvrant la tumeur, ce qui est un signe diagnostique favorable.
La documentation du diamètre de la base et de la hauteur des naevi choroïdiens et des mélanomes est une application importante de l’échographie en mode B pour ces affections. Ces dimensions ont d’importantes implications pronostiques et thérapeutiques pour ces lésions selon les résultats de la Collaborate Ocular Melanoma Study (COMS)[36,37]. En ce qui concerne la hauteur de la lésion, les lésions d’une hauteur ≥ 2,0 mm sont généralement considérées comme de petits mélanomes et les lésions d’une hauteur < 2,0 mm sont généralement considérées comme des naevi[38,39]. Le vide acoustique évoque également davantage un mélanome qu’un naevus. Cependant, la documentation d’une grosseur (ou de l’absence de grosseur) sur une série de photographies et sur une échographie est le facteur le plus important pour différencier un mélanome choroïdien d’un naevus.
Conclusion
Les modalités d’imagerie habituelles utilisées pour documenter diverses maladies rétiniennes vont des modalités traditionnelles (p. ex., photographie du fond d’œil) à des modalités plus nouvelles (p. ex., angiographie-TCO). Ces modalités peuvent toutes améliorer notre compréhension des maladies rétiniennes courantes. Les appareils d’imagerie rétinienne ont fait l’objet de progrès constants avec des améliorations technologiques régulières et l’utilisation de l’imagerie multimodale peut considérablement améliorer notre compréhension de diverses maladies rétiniennes.
Le Dr Koushan est un spécialiste de la rétine à l’hôpital Mount Sinai, au Toronto Retina Institute et au Mississauga Retina Institute. Il est professeur au département d’ophtalmologie et des sciences de la vision, de l’université de Toronto, et investigateur principal au sein du réseau de recherche clinique en rétinopathie diabétique.
Références:
-
Jackman WT, Webster JD. On Photographing the Retina of the Living Human Eye. Philadelphia Photographer. 1886;xxiii(275):340-341.
-
Saine PJ, Tyler ME. Ophthalmic Photography: a Textbook of Fundus Photography, Angiography, and Electronic Imaging. Oxford (UK): Butterworth-Heinemann. 1997.
-
Ghajarnia M, Ho LY, Abdelghani WM, Eller AW, Friberg TR, Schwartz S. OPTOS Panaromic 200 imaging versus standard fundus photography in measurement of pigmented choroidal lesions. Invest Ophthalmol Vis Sci. 2007;48(13):1204.
-
Noble J, Silva PS, Cavallerano JD, et coll. Comparison of nonmydriatic Optos® fundus imaging with mydriatic Early Treatment Diabetic Retinopathy Study (ETDRS) 7-standard field stereo photography and clinical grading. Invest Ophthalmol Vis Sci. 2011;52(14):1283.
-
Bennett TJ. Monochromatic fundus photography. Available at: http://www.opsweb.org/?page=Monochromatic. Accessed on January 27, 2016.
-
Ryan SJ, Schachat AP, Wilkinson CP, et coll. Retina. 5th ed. Philadelphia (PA): Elsevier Saunders; 2013.
-
Yannuzzi LA, Ober MD, Slakter JS, et coll. Ophthalmic fundus imaging: today and beyond. Am J Ophthalmol. 2004;137(3):511-524.
-
Schmitz-Valckenberg S, Lara D, Nizari S, et coll. Localisation and significance of in vivo near-infrared autofluorescent signal in retinal imaging. Br J Ophthalmol. 2011;95(8):1134-1139.
-
Gibbs D, Cideciyan AV, Jacobson SG, Williams DS. Retinal pigment epithelium defects in humans and mice with mutations in MYO7A: imaging melanosome-specific autofluorescence. Invest Ophthalmol Vis Sci. 2009;50(9):4386-4393.
-
Kellner U, Kellner S, Weinitz S. Fundus autofluorescence (488 NM) and near-infrared autofluorescence (787 NM) visualize different retinal pigment epithelium alterations in patients with age-related macular degeneration. Retina. 2010;30(1):6-15.
-
Spaide RF. Fundus autofluorescence and age-related macular degeneration. Ophthalmology. 2003;110(2):392-399.
-
Gabriele ML, Wollstein G, Ishikawa H, et coll. Optical coherence tomography: history, current status, and laboratory work. Invest Ophthalmol Vis Sci. 2011;52(5):2425-2436.
-
Mrejen S, Spaide RF. Optical coherence tomography: imaging of the choroid and beyond. Survey of Ophthalmology. 2013;58(5):387-429.
-
Spaide RF, Fujimoto JG, Waheed NK. Image artifacts in optical coherence tomography angiography. Retina. 2015;35(11):2163-2180.
-
Duker JS, Kaiser PK, Binder S, et coll. The International Vitreomacular Traction Study Group classification of vitreomacular adhesion, traction, and macular hole. Ophthalmology. 2013;120(12):2611-2619.
-
Yannuzzi LA. Type-A behavior and central serous chorioretinopathy. Retina. 1987;7(2):111-131.
-
Zakir SM, Shukla M, Simi Z-U-R, Ahmad J, Sajid M. Serum cortisol and testosterone levels in idiopathic central serous chorioretinopathy. Indian J Ophthalmol. 2009;57(6):419-422.
-
Guyer DR, Yannuzzi LA, Slakter JS, Sorenson JA, Ho A, Orlock D. Digital indocyanine green videoangiography of central serous chorioretinopathy. Arch Ophthalmol. 1994;112(8):1057-1062.
-
Yannuzzi LA, Slakter JS, Gross NE, et coll. Indocyanine green angiography-guided photodynamic therapy for treatment of chronic central serous chorioretinopathy: a pilot study. Retina. 2003;23(3): 288-298.
-
Teussink MM, Breukink MB, van Grinsven MJJP, et coll. OCT angiography compared to fluorescein and indocyanine green angiography in chronic central serous chorioretinopathy. Invest Ophthalmol Vis Sci. 2015;56(9):5229-5237.
-
Cennamo G, Vecchio EC, Finelli M, Velotti N, de Crecchio G. Evaluation of ischemic diabetic maculopathy with Fourier-domain optical coherence tomography and microperimetry. Can J Ophthalmol. 2015;50(1):44-48.
-
Sim DA, Keane PA, Fung S, et coll. Quantitative analysis of diabetic macular ischemia using optical coherence tomography. Invest Ophthalmol Vis Sci. 2014;55(1):417-423.
-
de Carlo TE, Chin AT, Bonini Filho MA, et al. Detection of microvascular changes in eyes of patients with diabetes but not clinical diabetic retinopathy using optical coherence tomography angiography. Retina. 2015;35(11):2364-2370.
-
Takase N, Nozaki M, Kato A, Ozeki H, Yoshida M, Ogura Y. Enlargement of foveal avascular zone in diabetic eyes evaluated by en face optical coherence tomography angiography. Retina. 2015;35(11): 2377-2383.
-
Couturier A, Mané V, Bonnin S, et coll. Capillary plexus anomalies in diabetic retinopathy on optical coherence tomography angiography. Retina. 2015;35(11):2384-2391.
-
Schick T, Ersoy L, Lechanteur YTE, et coll. History of sunlight exposure is a risk factor for age-related macular degeneration. Retina. Oct 5. [Epub ahead of print]
-
Joachim N, Mitchell P, Burlutsky G, Kifley A, Wang JJ. The incidence and progression of age-related macular degeneration over 15 years: the Blue Mountains Eye Study. Ophthalmology. 2015; 122(12):2482-2489.
-
Buitendijk GHS, Rochtchina E, Myers C, et coll. Prediction of age-related macular degeneration in the general population: the Three Continent AMD Consortium. Ophthalmology. 2013;120(12):2644-2655.
-
Macular Photocoagulation Study Group. Subfoveal neovascular lesions in age-related macular degeneration: guidelines for evaluation and treatment in the macular photocoagulation study. Arch Ophthalmol. 1991;109(9):1242-1257.
-
Keane PA, Liakopoulos S, Ongchin SC, et coll. Quantitative subanalysis of optical coherence tomography after treatment with ranibizumab for neovascular age-related macular degeneration. Invest Ophthalmol Vis Sci. 2008;49(7):3115-3120.
-
Framme C, Panagakis G, Birngruber R. Effects on choroidal neovascularization after anti-VEGF upload using intravitreal ranibizumab, as determined by spectral domain-optical coherence tomography. Invest Ophthalmol Vis Sci. 2010;51(3):1671-1676.
-
Jia Y, Bailey ST, Wilson DJ, et coll. Quantitative optical coherence tomography angiography of choroidal neovascularization in age-related macular degeneration. Ophthalmology. 2014;121(7): 1435-1444.
-
Kuehlewein L, Bansal M, Lenis TL, et coll. Optical coherence tomography angiography of type 1 neovascularization in age-related macular degeneration. Am J Ophthalmol. 2015;160(4):739-748.e2.
-
Kuehlewein L, Sadda SR, Sarraf D. OCT angiography and sequential quantitative analysis of type 2 neovascularization after ranibizumab therapy. Eye (Lond). 2015;29(7):932-935.
-
Singh AD, Kalyani P, Topham A. Estimating the risk of malignant transformation of a choroidal nevus. Ophthalmology. 2005; 112(10):1784-1789.
-
Diener-West M, Earle JD, Fine SL, et coll; Collaborative . The COMS randomized trial of iodine 125 brachytherapy for choroidal melanoma, III: initial mortality findings: COMS Report No. 18. Arch Ophthalmol. 2001;119(7):969-982.
-
Hawkins BS; Collaborative Ocular Melanoma Study Group. The Collaborative Ocular Melanoma Study (COMS) randomized trial of pre-enucleation radiation of large choroidal melanoma: IV. Ten-year mortality findings and prognostic factors. COMS report number 24. Am J Ophthalmol. 2004;138(6):936-951.
-
The Collaborative Ocular Melanoma Study Group. Factors predictive of growth and treatment of small choroidal melanoma: COMS Report No. 5. Arch Ophthalmol. 1997;115(12):1537-1544.
-
Butler P, Char DH, Zarbin M, Kroll S. Natural history of indeterminate pigmented choroidal tumors. Ophthalmology. 1994;101(4): 710-716.
Énoncé de divulgation : Le Dr Koushan n’a aucune divulgation à faire en association avec le contenu de
cette publication.

Figure 1. Photographie des 7 champs standardisés du fond d’œil selon la classification de l’ETDRS (Early Treatment of Diabetic Retinopathy Study)


Figure 2. Images d’angiographie à la fluorescéine (AF) grand angle chez deux patients atteints de rétinopathie drépanocytaire proliférante. A. Appareil Optos®. B. Spectralis® de Heidelberg avec la lentille de Staurenghi. Les zones entourées d’une ligne pointillée représentent une néovascularisation rétinienne. La zone entourée d’une ligne continue représente une ischémie périphérique.
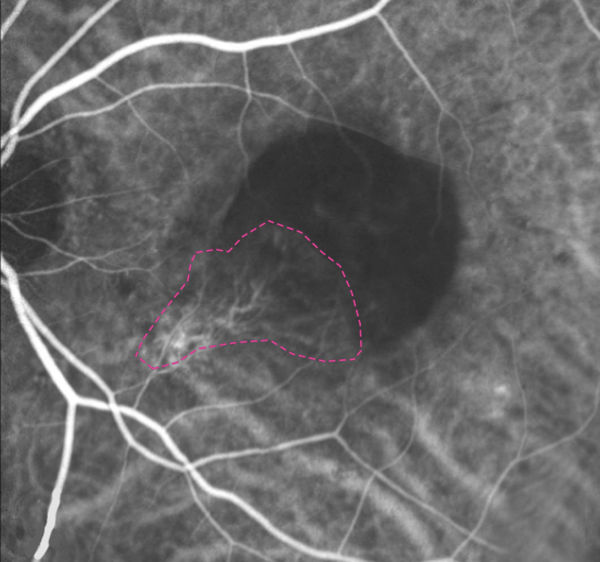
Figure 3. Angiographie au vert d’indocyanine montrant une lésion néovasculaire choroïdienne de l’épithélium pigmentaire sous-rétinien (EPR) (entourée d’une ligne pointillée). Reproduit avec la permission de Ryan SJ. Retina. 5e éd. Philadelphie (PA): Elsevier Saunders; 2013. Copyright© 2013. Elsevier Health Science Books.

Figure 4. Imagerie multimodale pour la dégénérescence maculaire liée à l’âge (DMLA) de type sèche avec atrophie géographique de l’EPR. A : AF. B. Autofluorescence du fond d’œil. C : Autofluorescence proche infrarouge. Images utilisées avec la permission de Kellner U et al. Retina. 2010;30(1):6-15.

Figure 5. Angiographie-TCO (tomographie par cohérence optique) de l’œil gauche chez un patient présentant une DMLA néovasculaire. A : Système vasculaire de la rétine superficielle. B. Système vasculaire de la rétine profonde. C : Rétine extérieure avec des traces de vaisseaux aberrants (Ce panneau serait normalement dénué de vaisseaux). D : Couche choriocapillaire montrant la membrane néovasculaire choroïdienne (entourée d’une ligne pointillée rouge). E,F : Images de TCO en mode B juxtaposées montrant le liquide intrarétinien dû à la NVC. Images gracieusement offertes par le Dr David Chow, Toronto Retina Institute.
Figure 7. TCO d’un œil atteint de choriorétinopathie séreuse centrale (CRSC) chronique. A : Initialement. B. Réduction modérée du volume de liquide sous-rétinien 5 mois après le traitement laser focal et à microimpulsion.


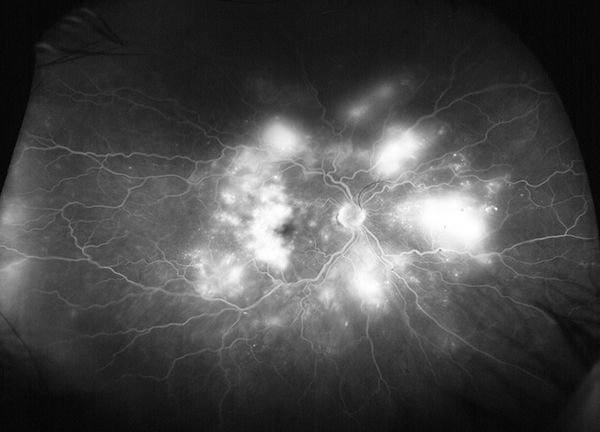
Figure 9. AF à angle ultra large (utilisant un appareil Optos®) d’un œil atteint de rétinopathie diabétique proliférante montrant des zones multiples de néovascularisation rétinienne et une fuite maculaire diffuse.
Figure 10. Membrane NVC occulte (type 1). AF montrant des décollements de l’épithélium pigmentaire (DEP) fibrovasculaire comme des zones définies d’hyperfluorescence selon un schéma tacheté (entourées d’une ligne pointillée). Image utilisée avec la permission de Ryan SJ. Retina. 5e éd. Philadelphie (PA): Elsevier Saunders ; 2013. Copyright©2013. Elservier Health Science Books.

Figure 11. AF d’une membrane néovasculaire choroïdienne occulte montrant une fuite tardive de source indéterminée. A : Phase précoce sans hyperfluorescence choroïdienne apparente. B : Phase intermédiaire montrant une légère hyperfluorescence temporalement à la fovéa. C : Phase tardive montrant une hyperfluorescence sur la partie temporale et nasale de la fovéa.



Figure 12. TCO de l’œil visualisé à la Figure 11 montrant le DEP néovasculaire (flèches rouges) et le liquide intrarétinien (flèches verts).
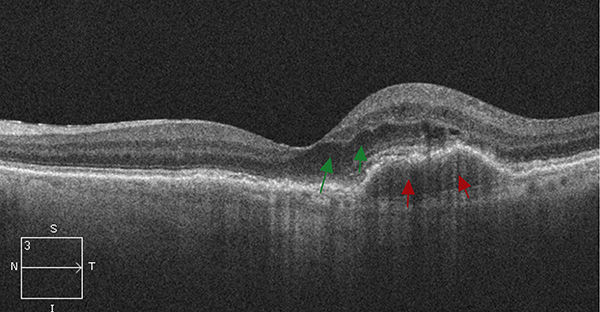
Figure 13. Réponse de la membrane néovasculaire choroïdienne à une injection d’inhibiteur du facteur de croissance de l’endothélium vasculaire visualisée par une angiographie-TCO (A-TCO). A-D : Réduction rapide et disparition du complexe néovasculaire choroïdien en réponse aux injections mensuelles de ranibizumab. E : La réapparition du complexe néovasculaire choroïdien après l’intervalle thérapeutique est prolongée de 6 semaines. Les panneaux inférieurs représentent les balayages de TCO en mode B des images de TCO en mode A correspondantes. Images gracieusement offertes par le Dr David Chow, Toronto Retina Institute.

Figure 6. Exemples d’anomalies vitréomaculaires visualisées en TCO. A : Traction vitréomaculaire (TVM). B : Trou maculaire de pleine épaisseur sans TVM résiduelle.




Figure 8. AF de l’œil droit chez un patient atteint de choriorétinite séreuse centrale chronique. A : Phase précoce de l’angiographie montrant un point de fuite précoce (flèche). B : Phase tardive d’une angiographie montrant l’apparence de cheminée du point de fuite (flèche).
La publication d’Ophtalmologie – Conférences scientifiques est rendue possible grâce au soutien éducatif de