
Mise à jour sur la dégénérescence maculaire liée à l’âge –
Partie 1 : Tendances actuelles et futures en matière de diagnostic
Par DAVID TRI TA KIM, M.D., FRCSC, et ALAN RICHARD BERGER, M.D., FRCSC
La dégénérescence maculaire liée à l’âge (DMLA) se situe parmi les causes les plus fréquentes de cécité dans les pays occidentaux et elle est la quatrième cause la plus fréquente dans le monde¹⁻⁵. Le taux de prévalence globale de la DMLA est de 8,7 %. Cependant, on a constaté qu’il était plus élevé dans les pays européens comparativement aux pays asiatiques ou africains5. Comme son nom l’implique, l’âge est le principal facteur de risque de DMLA. Une revue systématique et méta-analyse européenne a estimé que la prévalence de la DMLA au stade précoce ou intermédiaire était de 25,3 % et la prévalence de la DLMA au stade avancé était de 2,4 % chez les patients âgés ≥ 60 ans2 et une méta-analyse globale a révélé que >14 % des cas de cécité étaient dus à la DMLA chez les patients âgés ≥ 50 ans dans les sous-régions à revenu élevé4. Le vieillissement de la population devrait augmenter la prévalence de la DMLA dans le monde de 46 % d’ici 2040 d’après les estimations de 2020 (de 196 millions de cas à 288 millions)⁵.
Caractéristiques cliniques
La DMLA est caractérisée par la présence de drusen. Ce sont des dépôts jaunâtres dans l’épithélium pigmentaire rétinien (EPR) ou dans la membrane de Bruch. Les drusen peuvent être décrits en fonction de leur taille : petits (< 64 µm de diamètre), intermédiaires (64–124 µm) ou grands (≥125 µm). Ils peuvent être décrits également en fonction de leurs contours : durs, mous ou confluents. La présence de quelques petits drusen durs ne semble pas être un facteur de risque de DMLA, étant donné qu’on les trouve couramment dans les échantillons histopathologiques de patients âgés ≥ 50 ans⁶.
Les pseudo-drusen réticulés, appelés également dépôts drusénoïdes sous-rétiniens ou drusen réticulés, ont l’aspect de dépôts jaunâtres individuels en réseau (Figure 1). La régression de ces lésions est associée à une atrophie de la rétine externe et à une diminution de l’épaisseur de la choroïde sous-jacente⁷. La présence de pseudo-drusen réticulés est un facteur prédictif indépendant d’évolution vers une DMLA de stade tardif, conformément à la classification élaborée par le groupe d’étude AREDS (Age-related Eye Disease Study) (Tableau 1)⁸⁻⁹, bien que le degré de probabilité soit bien inférieur à celui obtenu avec les drusen mous. Comme une étude prospective cas-témoin l’a démontré, le ratio de probabilité (odds ratio) de développer une DMLA avancée chez les patients présentant des pseudo-drusen réticulés était de 2,6 comparativement à 16,6 pour les drusen mous¹⁰.
Figure 1. Dépôts drusénoïdes sous-rétiniens.

Cette image a été publiée initialement sur le site web de la Retina Image Bank®. Auteur : Gerardo Garcia-Aguirre, M.D. Dépôts drusénoïdes sous-rétiniens. Retina Image Bank. 2018; Numéro de l’image 28339. © the American Society of Retina Specialists.
Tableau 1. Classification de la DMLA élaborée par le groupe AREDS⁸⁻⁹
Les lésions vitelliformes sont visibles à l’examen du fond d’œil sous la forme de lésions rondes ayant l’apparence d’un jaune d’œuf centrées généralement sur la fovéa et représentent une accumulation de dépôts jaunâtres dans l’espace sous-rétinien. Ces lésions sont peu communes dans les yeux atteints de DMLA sèche typique. On pense qu’elles sont dues à une altération de la phagocytose des segments externes des photorécepteurs, bien que l’on ne sache pas si leur formation résulte de la pathogenèse de la DMLA ou d’un processus pathologique secondaire. Les lésions vitelliformes se présentent généralement sous la forme d’une seule lésion dans la fovéa, mais peuvent également être présentes dans de nombreuses zones maculaires non centrales¹¹. La régression des lésions vitelliformes est associée à l’atrophie de l’ellipsoïde et de l’EPR. Elles sont parfois associées au développement de membranes néovasculaires choroïdiennes.
D’autres constatations cliniques relatives à la DMLA incluent une hyperpigmentation focale de l’EPR et une atrophie géographique et non géographique. L’atrophie géographie (AG) est une zone d’atrophie circonscrite ou éparse de l’EPR, généralement dans la région centrale ou paracentrale de la macula. Les photorecepteurs sur les zones d’AG dégénèrent habituellement, entraînant une perte de vision. La régression des grands drusen est associée au développement d’une AG et la région maculaire totale occupée par les drusen est un facteur de risque d’AG¹². Il a été proposé que la séquence d’événements entraînant une AG commence par le développement de drusen et est suivie de l’apparition de zones focales d’hyperpigmentation, d’une régression des drusen, de l’apparition d’une hypopigmentation et enfin d’une AG¹³. Une AG peut également survenir à la suite de la rupture d’un décollement de l’épithélium pigmentaire (DEP), en particulier dans les cas de DEP drusénoïdes¹⁴. Une AG peut également se développer dans des régions sans drusen ainsi qu’autour de la fovéa. Dans ce dernier cas, l’AG s’étend en « fer à cheval », pour finalement entourer et toucher la fovéa.
En plus de son système de classification, le groupe d’étude AREDS a également créé une échelle de classification simplifiée pour évaluer la sévérité de la DMLA sur la base de la présence ou de l’absence des anomalies rétiniennes suivantes : ≥ 1 drusen de grande taille (diamètre >125 µm) (1 point); présence d’anomalies pigmentaires (1 point); pour les patients sans grands drusen, présence de façon bilatérale de drusen de taille intermédiaire (64–124 µm) (1 point) et présence d’une DMLA néovasculaire (2 points)¹⁵. Ces facteurs de risque pour chaque œil sont additionnés pour estimer le risque de développer une DMLA avancée dans les 5 à 10 ans (Tableau 2).
Tableau 2. Risque à 5 et 10 ans de survenue d’une DMLA tardive sur la base d’une échelle d’évaluation simplifiée élaborée par le groupe AREDS¹⁵
La néovascularisation choroïdienne (NVC) est caractéristique de la DMLA néovasculaire (« humide »). La NVC est la formation de nouveaux vaisseaux sanguins dans une ou plusieurs régions de la choroïde à travers la membrane de Bruch et dans les espaces sous l’EPR, sous-rétinien et intra-rétinien. La NVC entraîne généralement une fuite liquidienne dans ces espaces et les symptômes visuels qui en résultent. À l’examen du fond d’œil, la NVC peut parfois être visualisée comme une élévation gris-vert du tissu profond de la rétine. La NVC n’est souvent pas visible et la visualisation de sang, de lipides, de liquide sous-rétinien ou d’un DEP permet de déduire sa présence (Figure 2). Ces observations cliniques peuvent être subtiles et un examen clinique complet est donc essentiel.
Figure 2. Patient âgé de 80 ans, DEP / MNVC

Cette image a été publiée initialement sur le site web de la Retina Image Bank®. Auteur : Gerardo Garcia-Aguirre, M.D. Dépôts drusénoïdes sous-rétiniens. Retina Image Bank. 2018; Numéro de l’image 28339. © the American Society of Retina Specialists.
Les DEP se produisent lorsque la partie interne épaissie de la membrane de Bruch et l’EPR se décollent du reste de la membrane. Les DEP peuvent être drusénoïdes, séreux, fibrovasculaires ou hémorragiques. Les DEP drusénoïdes ne sont pas associés à une NVC. Cependant, l’étude AREDS a révélé que le risque d’évolution vers une DMLA avancée à 5 ans était de 42 % pour les yeux présentant des DEP drusénoïdes, ceux-ci pouvant être associés dans la même proportion à une AG fovéale et à une NVC¹⁴. Les DEP fibrovasculaires et hémorragiques sont associés à une NVC, tout comme peuvent l’être les DEP séreux. Les signes cliniques suggérant une NVC associée à un DEP incluent la présence de liquide sous-rétinien, de lipide, de sang et de plis choriorétiniens¹⁶. L’angiographie par injection de fluorescéine (AGF) ou la tomographie par cohérence optique-angiographie (TCO-A) permettent de différencier les types de DEP et la présence éventuelle d’une NVC.
La prolifération angiomateuse rétinienne est une forme de NVC qui serait issue des couches internes de la rétine. Il apparaît que les vaisseaux rétiniens s’anastomosent avec la membrane néovasculaire. On ne sait pas précisément si ces vaisseaux se développent avant ou après la NVC. À l’OCT, les caractéristiques les plus courantes sont un DEP séreux causant un œdème maculaire cystoïde (OMC) sus-jacent.
L’hémorragie sous-rétinienne massive est une complication rare de la DMLA humide, mais dont les conséquences sur le pronostic visuel sont catastrophiques. L’hémorragie du vitré survient à la suite de l’irruption subite de sang qui passe à travers la rétine dans la cavité vitréenne.
Les déchirures de l’EPR, ou ruptures de l’EPR, sont souvent associées à une NVC, en particulier en présence d’un DEP. Elles peuvent se produire spontanément, après une thérapie photodynamique ou après un traitement antiangiogénique¹⁷⁻¹⁸. On pense que le DEP a pour effet d’étirer l’EPR, entraînant finalement sa déchirure. La couche de cellules qui forment l’EPR se rétracte ensuite, laissant une zone vide. Le pronostic visuel est médiocre lorsque la déchirure de l’EPR s’étend sous la fovéa.
La formation de cicatrices disciformes marque la phase finale de la NVC. Elles sont caractérisées par une fibrose sous l’EPR ou sous-rétinienne. En règle générale, la vision centrale est gravement altérée lorsque les cicatrices s’étendent sous le centre de la fovéa. De nouvelles zones de néovascularisation peuvent apparaître sur les bords et toucher des zones de la rétine qui ne l’étaient pas précédemment (Figure 3).
Figure 3. Cicatrice disciforme avec une région active inférotemporale de DMLA néovasculaire.

Cette image a été publiée initialement sur le site web de la Retina Image Bank®. Auteur : Mitzy E Torres Soriano, M.D. Titre : DMLA néovasculaire active avec une cicatrice disciforme. Retina Image Bank. 2015; Numéro de l’image 24986. © the American Society of Retina Specialists.
Surveillance à domicile
Grille d’Amsler
La grille d’Amsler est un test de dépistage à l’aide d’une grille quadrillée comportant un point central pour la fixation. Il est proposé aux patients pour une auto-surveillance de nouveaux symptômes visuels pouvant suggérer une évolution de la DMLA. Chaque œil est testé individuellement pour identifier de nouvelles zones de métamorphopsie, de scotomes ou d’autres changements qui nécessiteraient une consultation chez un ophtalmologue. Les auteurs d’une méta-analyse ont constaté que la grille d’Amsler avait une sensibilité de 64 à 87 % et une spécificité de 91 à 99 % pour détecter une NVC. Cependant, les auteurs notent que de nombreuses études utilisaient des tests de référence différents et possiblement sous-optimaux, ce qui pourrait compromettre la validité de la méta-analyse¹⁹. Une autre publication montre que de nombreux patients ne sont pas correctement informés sur la façon de réaliser et d’interpréter le test de la grille d’Amsler²⁰.
Tests diagnostiques
AGF
La DMLA est associée à de nombreux signes différents à l’angiographie par injection de fluorescéine (AGF). Les lésions hyperfluorescentes peuvent représenter des drusen, une atrophie de l’EPR, des ruptures de l’EPR, des DEP séreux, une NVC, une fibrose sous-rétinienne et des cicatrices de laser. Les lésions hypofluorescentes peuvent correspondre à une hémorragie, quel que soit son niveau, la présence de lipides ou à une prolifération pigmentaire.
La NVC peut être classique ou occulte. Les lésions classiques se présentent comme une petite zone focale bien définie d’hyperfluorescence que l’on peut observer durant la phase précoce de l’angiographie. Pendant les phases intermédiaire et tardive, l’hyperfluorescence augmente d’intensité et s’étend au-delà des limites de la zone identifiée durant la première phase. La NVC occulte se caractérise par deux formes d’hyperfluorescence à l’AGF. La première forme est un DEP fibrovasculaire caractérisé par une élévation irrégulière de l’EPR avec des points hyperfluorescents. Les limites peuvent être ou non bien définies. La deuxième forme est une fuite tardive dont l’origine est indéterminée. Il n’y a pas de lésion clairement identifiable dans les phases précoce ou intermédiaire de l’angiographie d’un DEP de type classique ou fibrovasculaire, permettant d’expliquer la zone de fuite dans la phase tardive. Dans cette forme de DEP, les limites ne peuvent généralement pas être déterminées. Cette classification de la NVC était plus fréquemment utilisée dans le passé, étant donné qu’elle avait un impact sur le choix de la prise en charge thérapeutique. À l’ère de l’anti-angiogenèse, cette classification est rarement utilisée dans la pratique clinique. La NVC classique est plus susceptible de progresser et d’entraîner une perte de vision plus sévère²¹.
Les différents types de DEP (fibrovasculaire, séreux, hémorragique et drusénoïde) peuvent être différenciés à l’AGF. Les DEP fibrovasculaires montrent une hyperfluorescence tachetée dans la phase intermédiaire avec une accumulation du colorant dans la phase tardive. Les DEP séreux montrent une hyperfluorescence lumineuse dans la phase précoce avec une fuite minime ou inexistante au bord du DEP dans la phase tardive. Les DEP hémorragiques bloqueront la fluorescence choroïdienne. Les DEP drusénoïdes surviennent dans les zones de grands drusen confluents et sont faiblement fluorescents.
Les cicatrices disciformes sont fréquemment hyperfluorescentes en raison des fuites et de la coloration.
Autofluorescence du fond d’œil (AFF)
Les drusen n’ont fait l’objet d’aucune constatation significative à l’AFF. Cependant, l’AG apparaît comme des zones clairement définies d’hypoautofluorescence en raison de la perte d’EPR et de la diminution correspondante de l’accumulation de lipofuscine. L’hyperautofluorescence dans la zone de jonction qui borde le tissu non atrophique est associée à la progression plus rapide de l’AG²². L’utilisation de l’AFF joue un rôle important dans la surveillance de la progression de la DMLA sèche et de l’AG.
OCT
Depuis son introduction en 1991, l’OCT a révolutionné le diagnostic de la DMLA en produisant des images de la rétine en coupe transversale, à haute résolution selon une méthode non invasive²³. La première génération d’appareils d’OCT utilisés en clinique était l’OCT de type Time Domain ou TD-OCT qui utilisait une source lumineuse à large bande et un miroir de référence mobile pour l’acquisition des images. L’OCT de type Spectral-domain ou SD-OCT représente l’avancée technologique qui a suivi. Cette technologie n’utilisait plus un miroir de référence mobile, ce qui permettait l’acquisition plus rapide des images. Le mode SD a également amélioré la résolution axiale. La toute dernière génération d’OCT, l’OCT à source de balayage (SS-OCT), utilise une source lumineuse à bande étroite, qui permet la pénétration plus profonde des tissus et une meilleure résolution des structures, telles que la choroïde²⁴⁻²⁵.
Les drusen apparaissent à l’OCT comme de petites élévations de l’EPR ou comme des dépôts de forme convexe ayant une réflectivité interne faible, moyenne ou élevée (Figure 4)²⁶. Les drusen ayant une réflectivité moyenne sont les plus communs. Cependant, il est plus probable que les yeux ayant une réflectivité interne faible ou élevée présentent des zones d’atrophie de l’EPR, ce qui a déjà été établi comme un facteur de risque d’évolution vers une DMLA avancée²⁷. On note parfois un amincissement de la couche de photorécepteurs et des altérations de la zone ellipsoïde.
Figure 4. OCT démontrant la présence de multiples drusen ainsi que de foyers hyperréflectifs antérieurs aux drusen.
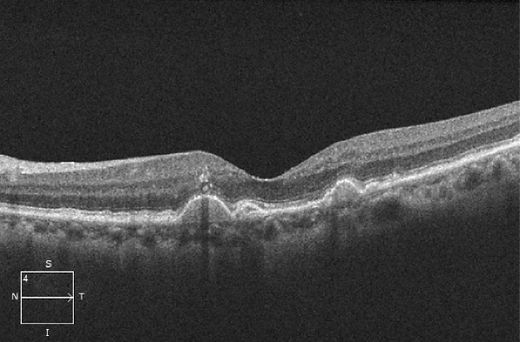
Des foyers modérément ou intensément hyperréflectifs situés antérieurement aux drusen peuvent apparaître (Figure 4), mais ils peuvent également se situer dans les couches rétiniennes plus antérieures. À l’examen clinique, ils correspondent à des foyers d’hyperpigmentation. Une étude auxiliaire des observations faites à l’examen de SD-OCT chez les patients de l’étude AREDS2 a révélé que dans les yeux présentant des drusen et des foyers hyperreflectifs, le risque d’évolution vers une AG dans un délai de 2 ans était 4,7 fois plus élevé28. Ce facteur de risque était accru en fonction du nombre de foyers hyperréflectifs ainsi que de la localisation plus antérieure²⁸.
Dans les zones d’AG, la couche nucléaire externe, la membrane limitante externe et la zone ellipsoïde sont absentes et l’EPR et la membrane de Bruch sont soit absents soit notablement atténués. La hyperréflectivité de la choroïde semble accentuée en raison d’un défaut de transmission et de l’effet « fenêtre » (Figure 5).
Figure 5. OCT démontrant une atrophie géographique sous-fovéale et l’absence de la couche nucléaire de la rétine externe, de la membrane limitante externe et de la zone ellipsoïde. La choroïde sous la zone d’AG est davantage hyperreflective en raison de l’effet « fenêtre ».

Une tabulation rétinienne externe (ORT) apparaît à l’OCT dans la couche nucléaire externe comme une ligne réflective épaisse entourant une cavité tubulaire hyporéflective. Les ORT se différencient des anomalies cystoïdes, qui n’apparaissent pas à l’OCT comme cette ligne réflective épaisse qui entoure la cavité. One pense que les ORT représentent des cônes rouges-verts et des cellules de Müller dégénérés, la ligne hyperréflective représentant les mitochodries²⁹⁻³⁰. Il est important d’identifier les ORT, étant donné qu’elles constituent des transformations chroniques et sont peu susceptibles de répondre aux injections d’inhibiteur du facteur de croissance de l’endothélium vasculaire (anti-VEGF).
L’avènement de l’OCT a permis aux cliniciens de visualiser facilement le liquide intrarétinien (Figure 6), sous-rétinien (Figure 7) et sous l’EPR et de faire objectivement le suivi des changements subtils par des clichés photographiques en série. L’exsudation lipidique apparaît comme des points hyperréflectifs dans la rétine externe. Les DEP séreux ont l’aspect d’élévations en forme de dôme de l’EPR recouvrant un espace hyporéflectif homogène, la membrane de Bruch étant visible au-dessous (Figures 7 et 8). Les DEP fibrovasculaires apparaissent remplis de couches denses de matière moyennement réflective séparées par des fentes hyporéflectives (Figure 9). Les DEP hémorragiques sont en forme de dôme, similaires aux DEP séreux. Cependant, le sang sous la couche d’EPR apparaît hyperréflectif, atténuant la visibilité des structures plus profondes.
Figure 6. OCT démontrant la présence de multiples drusen et de liquide intrarétinien.

Figure 7. OCT démontrant un DEP séreux, caractérisé par un espace hyporéflectif homogène, avec la présence de liquide sous-rétinien.

Figure 8. OCT démontrant un DEP séreux, caractérisé à nouveau par un espace hyperréflectif homogène.

Figure 9. OCT démontrant un DEP fibrovasculaire, caractérisé par des couches denses de matière moyennement réflective (flèche blanche) séparées par des fentes hyporéflectives (flèche noire), avec la présence de liquide sous-rétinien.

OCT-A
L’OCT-angiographie (OCT-A) est un nouvel examen rapide non invasif qui mesure le flux et produit des images de la vascularisation rétinienne et choroïdienne. L’OCT-A peut être réalisée au moyen de la technologie SD ou SS. Il ne nécessite pas l’injection de produit de contraste par intraveineuse et génère des cartes vasculaires au moyen d’un contraste associé au mouvement en prenant des clichés OCT B séquentiels dans une même section transversale. De nombreuses sections transversales sont balayées pour obtenir une carte vasculaire volumétrique ou en 3 D. La segmentation automatisée génère des angiogrammes « en face » en 2 D, permettant au clinicien d’étudier les différentes couches de la rétine; p. ex., rétine superficielle ou choriocapillaire. Les données peuvent également être visualisées sous forme d’images en coupe transversale (B-scan) avec des données sur le flux à code couleur, permettant ainsi d’identifier les zones de flux sanguin (Figure 10).
Figure 10. Un homme âgé de 71 ans présentant une DMLA humide d’apparition nouvelle. En haut : Photographie du fond d’œil montrant une membrane néovasculaire choroïdienne (MNVC) avec la présence de liquide sous-rétinien et d’une hémorragie sous-rétinienne. En bas à gauche : OCT-A « en face » de la MNVC. En bas à droite : Vue transversale de la MNVC avec le flux sanguin codé en rouge. La segmentation automatisée a été réalisée dans la rétine externe normalement avasculaire, dont les limites sont indiquées par les lignes pointillées violettes générant l’image « en face » présentée à gauche.

Les avantages de l’OCT-A par rapport à l’AFF incluent les temps d’acquisition plus rapides (secondes vs minutes), la nature non invasive de l’examen, la localisation plus précise de la profondeur des observations et une meilleure résolution possible31. Les inconvénients incluent l’incapacité à détecter les fuites, le champ de vision relativement étroit dans les versions actuelles et l’incapacité à différencier un faible flux de l’absence de flux, par exemple dans les micro-anévrismes dans la rétinopathie diabétique³¹.
Pour la DMLA sèche, l’OCT-A peut être utilisé pour exclure une NVC ainsi que pour faire le suivi de la progression de l’atrophie géographique, étant donné qu’il a été démontré que cet examen permet de quantifier de façon fiable l’étendue de l’AG³².
Pour la DMLA humide, l’OCT-A peut être utilisé pour identifier une NVC asymptomatique, c’est-à-dire une NVC sans signes d’exsudation à l’examen ou à l’OCT structurel. La NVC asymptomatique présente un risque plus élevé d’exsudation comparativement aux yeux sans NVC asymptomatique (21 % vs 4 % à 12 mois)³³. Dans ces cas, un suivi plus étroit peut être bénéfique. L’OCT-A peut également être utilisé chez ces patients pour surveiller la progression de la NVC par des examens en série, bien que les essais cliniques n’aient pas démontré que les examens d’OCT-A en série offrent un avantage dans la prise en charge de la NVC active. On utilise également l’OCT-A dans les cas de NVC soupçonnée et d’observations équivoques à l’AGF conventionnelle, étant donné que la différenciation entre l’affaissement d’une lésion vitelliforme acquise et une NVC active s’avère difficile à l’AGF, du fait de la forte coloration de la matière vitelliforme sous-rétinienne³⁴.
Résumé
Les options en matière d’examens diagnostiques pour la DMLA de formes sèche et humide se sont beaucoup améliorées au fil des années et leur amélioration continue. Le SS-OCT offre une meilleure résolution, une vue plus large et une résolution supérieure des tissus plus profonds. L’OCT-A permet une évaluation non invasive rapide de la vascularisation rétinienne et choroïdienne, bien qu’il n’ait pas totalement remplacé le rôle de l’AGF.
Références
-
Friedman DS, O’Colmain BJ, Muñoz B, et coll. Eye Diseases Prevalence Research Group. Prevalence of age-related macular degeneration in the United States. Arch Ophthalmol. 2004;122(4):564-572.
-
Li JQ, Welchowski T, Schmid M, Mauschitz MM, Holz FG, Finger RP. Prevalence and incidence of age-related macular degeneration in Europe: a systematic review and meta-analysis. Br J Ophthalmol. 2020;104(8):1077-1084.
-
Maberley DAL, Hollands H, Chuo J, et coll. The prevalence of low vision and blindness in Canada. Eye. 2006;20(3):341-346.
-
Flaxman SR, Bourne RRA, Resnikoff S, et coll; Vision Loss Expert Group of the Global Burden of Disease Study. Global causes of blindness and distance vision impairment 1990–2020: a systematic review and meta-analysis. Lancet Glob Health. 2017;5(12):e1221-1234.
-
Jonas JB, Gemmy Cheung CM, Panda-Jonas S. Updates on the epidemiology of age-related macular degeneration. Asia-Pac J Ophthalmol. 2017;6(6):493-497.
-
Coffey AJ, Brownstein S. The prevalence of macular drusen in postmortem eyes. Am J Ophthalmol. 1986;102(2):164-171.
-
Spaide RF. Outer retinal atrophy after regression of subretinal drusenoid deposits as a newly recognized form of late age-related macular degeneration. Retina. 2013;33(9):1800-1808.
-
Age-Related Eye Disease Study Research Group, 2001. A randomized, placebo-controlled, clinical trial of high-dose supplementation with vitamins C and E, beta carotene, and zinc for age-related macular degeneration and vision loss: AREDS report no. 8. Arch Ophthalmol. 2001;119(10):1417-1436.
-
Bressler NM, Bressler SB. Age-related macular degeneration: non-neovascular early AMD, intermediate AMD, and geographic atrophy. Dans : Ryan SJ, Schachat AP, Wilkinson CP, Hinton DR, Wiedemann P (réds.). Retina, 5e édition. Elsevier Health Sciences. 2013. Beijing, China. Page 1160.
-
Zweifel SA, Imamura Y, Spaide TC, Fujiwara T, Spaide RF. Prevalence and significance of subretinal drusenoid deposits (reticular pseudodrusen) in age-related macular degeneration. Ophthalmology. 2010;117(9):1775-1781.
-
Freund KB, Laud K, Lima LH, Spaide RF, Zweifel S, Yannuzzi LA. Acquired vitelliform lesions: correlation of clinical findings and multiple imaging analyses. Retina. 2011;31(1):13-25.
-
Complications of Age-related Macular Degeneration Prevention Trial (CAPT) Research Group. Risk factors for choroidal neovascularization and geographic atrophy in the complications of age-related macular degeneration prevention trial. Ophthalmology. 2008;115(9):1474-1479, 1479.e1-6.
-
Brader HS, Ying G, Martin ER, Maguire MG. Characteristics of incident geographic atrophy in the Complications of Age-related Macular Degeneration Prevention Trial. Ophthalmology. 2013;120(9):1871-1879.
-
Cukras C, Agrón E, Klein ML, et coll; Age-Related Eye Disease Study Research Group. Natural history of drusenoid pigment epithelial detachment in age-related macular degeneration: AREDS Report Number 28. Ophthalmology. 2010;117(3):489-499.
-
Ferris FL, Davis MD, Clemons TE, et coll; Age-Related Eye Disease Study Research Group. A simplified severity scale for age-related macular degeneration: AREDS Report No. 18. Arch Ophthalmol. 2005;123(11):1570-1574.
-
Bressler NM, Bressler SB, Fine SL. Age-related macular degeneration. Surv Ophthalmol. 1988;32(6):375-413.
-
Gelisken F, Inhoffen W, Partsch M, Schneider U, Kreissig I. Retinal pigment epithelial tear after photodynamic therapy for choroidal neovascularization. Am J Ophthalmol. 2001;131(4):518-520.
-
Meyer CH, Mennel S, Schmidt JC, Kroll P. Acute retinal pigment epithelial tear following intravitreal bevacizumab (Avastin) injection for occult choroidal neovascularisation secondary to age related macular degeneration. Br J Ophthalmol. 2006;90(9):1207-1208.
-
Faes L, Bodmer NS, Bachmann LM, Thiel MA, Schmid MK. Diagnostic accuracy of the Amsler grid and the preferential hyperacuity perimetry in the screening of patients with age-related macular degeneration: systematic review and meta-analysis. Eye (Lond). 2014;28(7):788-796.
-
Fine AM, Elman MJ, Ebert JE, Prestia PA, Starr JS, Fine SL. Earliest symptoms caused by neovascular membranes in the macula. Arch Ophthalmol. 1986;104(4):513-514.
-
Gregori G, Wang F, Rosenfeld PJ, Yehoshua Z, Gregori NZ, Lujan BJ, et coll. Spectral domain optical coherence tomography imaging of drusen in nonexudative age-related macular degeneration. Ophthalmology. 2011; 118(7):1373-1379.
-
Schmitz-Valckenberg S, Fleckenstein M, Scholl HPN, Holz FG. Fundus autofluorescence and progression of age-related macular degeneration. Surv Ophthalmol. 2009;54(1):96-117.
-
Huang D, Swanson EA, Lin CP, et coll. Optical coherence tomography. Science. 1991;254(5035):1178-1181.
-
Gabriele ML, Wollstein G, Ishikawa H, et coll. Optical Coherence Tomography: History, current status, and laboratory work. Invest Ophthalmol Vis Sci. 2011;52(5):2425-2436.
-
Lavinsky F, Lavinsky D. Novel perspectives on swept-source optical coherence tomography. Int J Retina Vitreous. 2016;2:25.
-
Khanifar AA, Koreishi AF, Izatt JA, Toth CA. Drusen ultrastructure imaging with spectral domain optical coherence tomography in age-related macular degeneration. Ophthalmology. 2008;115(11):1883-1890.
-
Leuschen JN, Schuman SG, Winter KP, et coll. Spectral-Domain Optical Coherence Tomography Characteristics of Intermediate Age-Related Macular Degeneration. Ophthalmology. 2013;120(1):140-150.
-
Christenbury JG, Folgar FA, O’Connell R, Chiu SJ, Farsiu S, Toth CA. Progression of intermediate age-related macular degeneration with proliferation and inner retinal migration of hyperreflective foci. Ophthalmology. 2013;120(5):1038-1045.
-
Curcio CA, Medeiros NE, Millican CL. Photoreceptor loss in age-related macular degeneration. Invest Ophthalmol Vis Sci. 1996;37(7):1236-1249.
-
Schaal KB, Freund KB, Litts KM, Zhang Y, Messinger JD, Curcio CA. Outer retinal tubulation in advanced age-related macular degeneration: optical coherence tomographic findings correspond to histology. Retina. 2015; 35(7):1339-1350.
-
Schneider EW, Fowler SC. Optical coherence tomography angiography in the management of age-related macular degeneration. Curr Opin Ophthalmol. 2018;29(3):217-225.
-
Corbelli E, Sacconi R, Rabiolo A, et coll. Optical coherence tomography angiography in the evaluation of geographic atrophy area extension. Invest Ophthalmol Vis Sci. 2017;58(12):5201-5208.
-
de Oliveira Dias JR, Zhang Q, Garcia JMB, et coll. Natural history of subclinical neovascularization in nonexudative age-related macular degeneration using swept-source OCT angiography. Ophthalmology. 2018;125(2):255-266.
-
Joshi KM, Nesper PL, Fawzi AA, Mirza RG. Optical coherence tomography angiography in adult-onset foveomacular vitelliform dystrophy. Retina. 2018;38(3):600-605.
Le DʳTa Kim est un fellow en chirurgie vitréorétinienne à l’hôpital St. Michael à Toronto, Ontario. Le Dʳ Berger est un chirurgien universitaire spécialisé en chirurgie vitréorétinienne à l’hôpital St. Michael et vice-président du Département d’ophtalmologie de l’Université de Toronto et co-directeur du Toronto Retina Institute.
Divulgations: Le Dʳ Ta Kim a indiqué qu’il n’a aucune divulgation à faire en association avec le contenu de cette publication. Le Dʳ Berger reçoit des honoraires et est un consultant pour Bayer Canada, Novartis Pharmaceuticals Canada, Allergan, et Roche Canada.
Novartis Pharmaceuticals Canada Inc.
Bausch Health Canada Inc.
Bayer Canada
Ophthalmology Rounds est rendu possible grâce à une subvention des commanditaires conjoints de l’industrie suivants :
Commanditaire
Ami
© 2020 Département d’ophtalmologie et des sciences de la vision, Faculté de médecine, Université de Toronto, seul responsable du contenu de cette publication. Édition : SNELL Communication Médicale Inc. avec la collaboration du Département d’ophtalmologie et des sciences de la vision, Faculté de médecine, Université de Toronto. MDOphtalmologie – Conférences scientifiques est une marque déposée de SNELL Communication Médicale Inc.Tous droits réservés. L’administration d’un traitement thérapeutique décrit ou mentionné dans Ophtalmologie – Conférences scientifiques doit toujours être conforme aux renseignements d’ordonnance approuvés au Canada. SNELL Communication Médicale se consacre à l’avancement de l’éducation médicale continue de niveau supérieur.